# Background
电池材料的开发受到材料组成、结构、性质之间复杂关系的约束。因此需要研究离子级别的相互作用,以及对电池性质的影响。
# Preliminaries
# 锂电池材料的通用表示
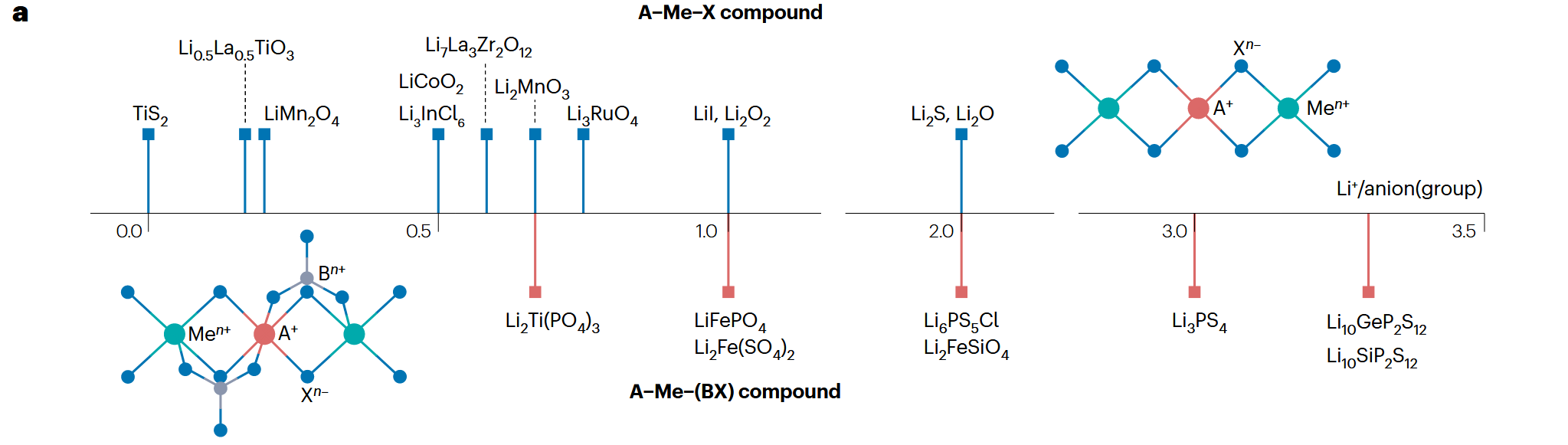
大多数锂电池材料可以表示为 A-Me-X 或者 A-Me-BX 形式。其中 A 表示 Li+, Na+, K+ 等。Me 表示金属阳离子,X 表示阴离子,BX 表示聚合阴离子基团 (polyanion groups). 比如 Li-Co-O2, Li3-PS4 等。
此时,发现定义 A 和 X (BX) 的数量比具有意义:
- 比值小于 2 时,材料一般用作电极材料。因为此时的金属阳离子 Me 和阴离子 X (BX) 形成了良好的框架,可以供锂离子嵌入或脱嵌,从而使得电极在充放电过程中更加稳定。
- 比值大于 2 时,材料一般用作电解质。因为此时阴离子大多是高电荷的聚合阴离子,会相互产生强斥力形成孤立的结构基团,从而促进了离子通路的形成。
下图说明了这一点。
# 离子电势
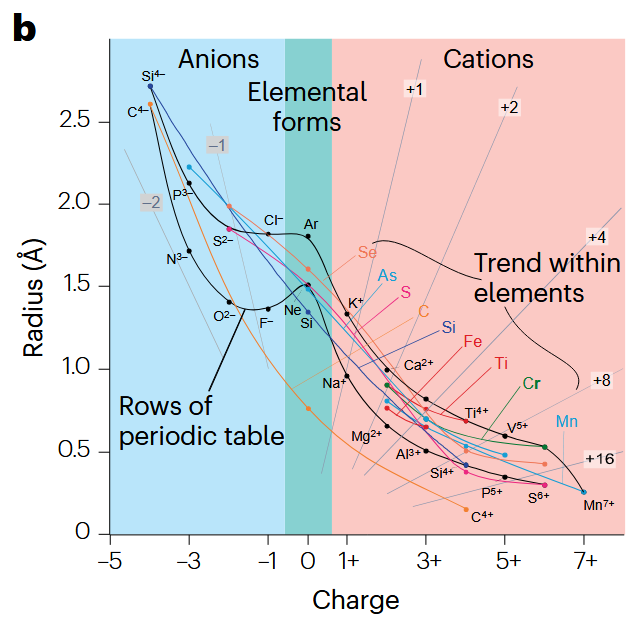
离子电势 (Ionic Potential) 定义为离子电荷与离子半径的比值,可以用来衡量材料结构内相互作用的强度。
进行这一定义的主要原因是,离子半径是进行材料设计时微观考虑的首要因素。但是同一元素的离子半径是伴随所携带电荷而发生强烈变化的,如下图所示。
# 设计电池材料的晶体结构
# 电极材料
电极材料以氧化物材料作为例子进行分析。
# 分层过渡金属氧化物的结构类型
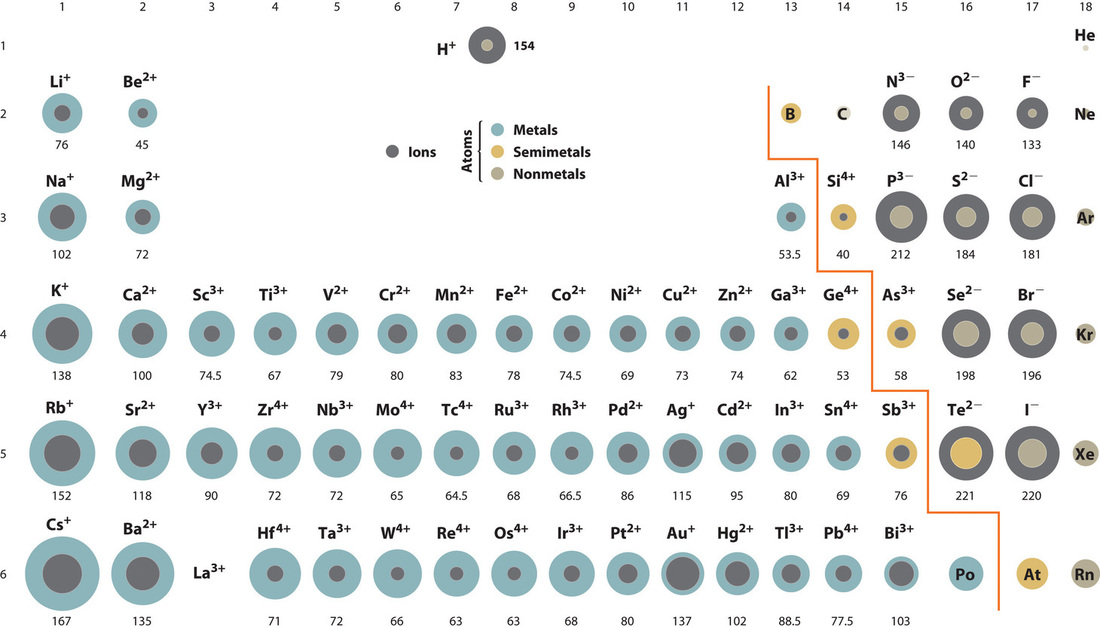
离子半径的变化规律
防止你忘掉初中学过的离子半径变化规律,列在下面(按重要级排序):
- 电子层数越多,离子半径越大
- 电子层数相同时,质子数越多,对外层电子的吸引能力越强,半径越小
比如 Li+ 的半径是 76 pm, Be2+ 的半径是 45 pm, N5+ 的半径是 13 pm, 但是 N3- 的半径是 146 pm, O2- 的半径是 140 pm. 另外,Na+ 的半径是 102 pm, K+ 的半径是 138 pm.
所以锂、钠离子的半径远小于氧离子的半径。在碱金属与过渡金属氧化物中,锂、钠离子填充在氧离子组成的空隙中。
分层过渡金属氧化物是常见的电池正极材料,比如 LiCoO2. 这类材料按照几何结构可以进行划分。通过氧原子层的堆积方式,可以划分为
- P2 (Prismatic): 周期为 2 的三棱柱型。
- O3 (Octahedral): 周期为 3 的八面体型。
- T (Tetragonal): 四面体型,似乎仅理论存在。(?)
Structural classification and properties of the layered oxides. Delmas et al. 1980. Physica B+C.
在分层过渡金属氧化物中,主要的结构是 P2 和 O3. 下图 a 和 b 展示了两种视角下的结构特点。可以看到,P2 结构中氧离子层的间距更大,更容易让锂离子通过。但是基于图 c 可以看出,锂离子大多为 O3 结构。
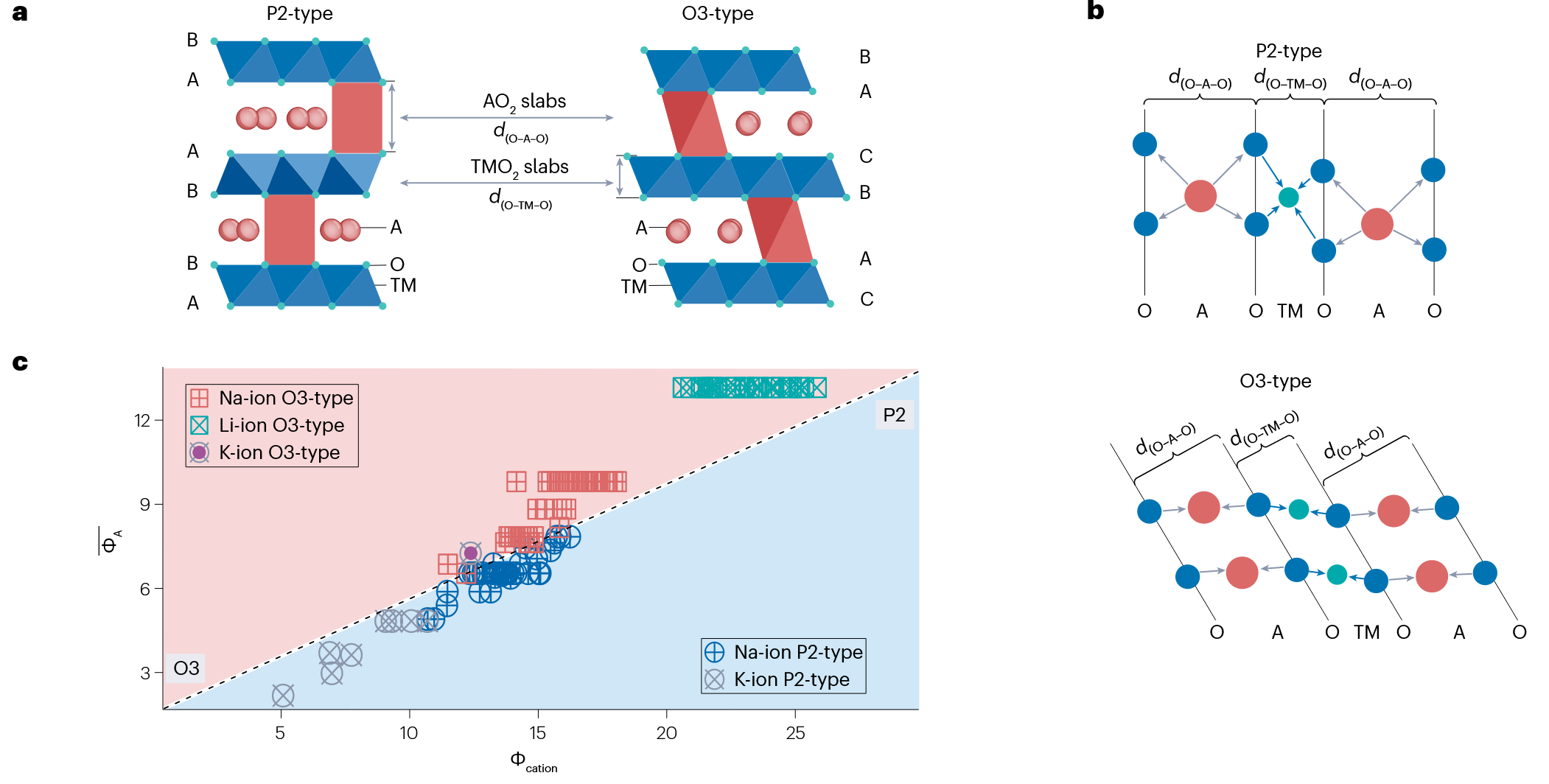
但是,结构不仅仅依赖于碱金属离子和氧离子的半径之比,也依赖于过渡金属离子的半径,也就是 TM 项。现在,通过将 TM 进行替换,可以生成许多 P2 或 O3 类型的材料。
# 电极材料的离子势
| 符号 | 公式 | 含义 |
|---|---|---|
| 碱金属离子的加权平均离子势 | ||
| 过渡金属 (TM) 离子的加权平均离子势 | ||
| 阳离子加权平均离子势 | ||
| - | 阴离子加权平均离子势 |
这里讨论的是氧化物晶体,因此这里的 就是氧的离子势,是一个常量。
利用该度量方式,可以对分层金属氧化物的结构进行预测,如下图所示:
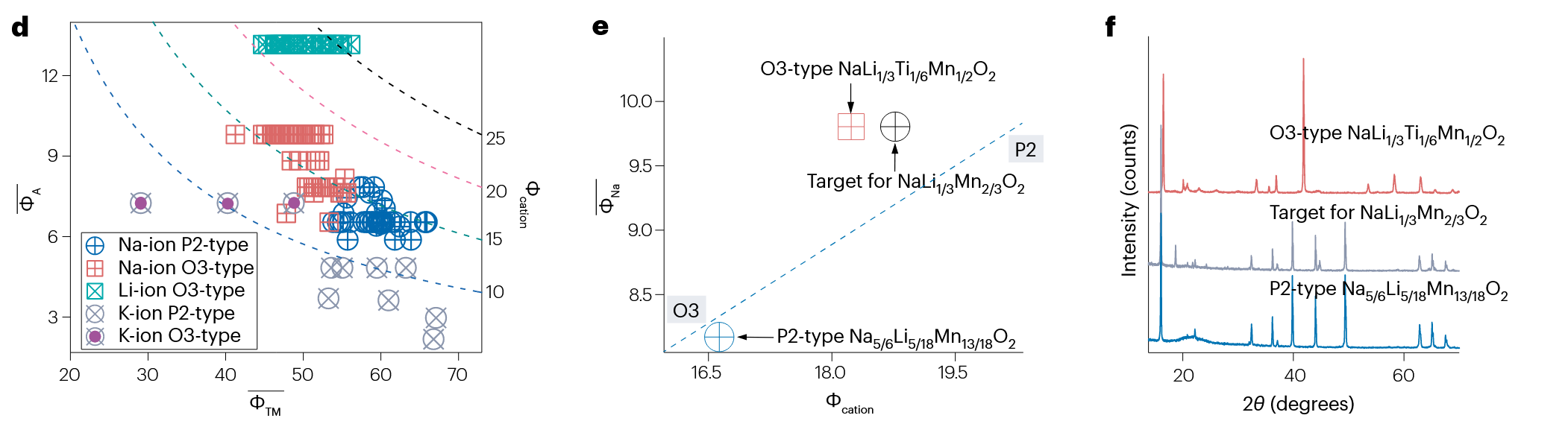
这里 越大,对应碱金属离子半径越小,越容易形成 O3 结构。这里引入 . 当 越大时,材料越容易形成 O3 结构。因此要尽可能降低 的大小,对应减小过渡金属离子的离子势 .
e, f 两图是对一种新的预测材料的验证。
# 电解质材料
电解质材料以卤化物材料作为例子进行分析。
# 结构类型
卤化物电解质包括三种重要的框架类型:
- 单斜晶系 (monoclinic, C2/m), 立方密堆积 (CCP)
- 三方晶系 (trigonal, P-3m1), 六方密堆积 (HCP)
- 正交晶系 (orthorhombic, Pnma), 六方密堆积 (HCP)
通常密堆积的类型使用金属离子的加权平均半径 和阴离子半径 的比值 来描述。但是这个比值不能区分上述三种框架。因为仅通过离子半径不能反映金属离子的电荷,而金属离子的电荷对对离子相互作用和结构稳定性存在较强的影响。单斜晶系具有较强的静电排斥力,对应更高的离子电导率。
不同于其它主要通过共价键影响结构的固态电解质,卤化物电解质主要通过离子键影响结构,尤其是 Me-X 离子键(因为 Me 和 X 的半径最大)。
# 卤化物电解质的离子势
于是,可以使用 Me 和 X 的离子势比值
来刻画卤化物电解质的结构。因为过渡金属和碱金属在化学式配方中处于竞争关系(加权求和是定值),因此使用 和 作为坐标轴进行可视化,可以观察到明显的现象。
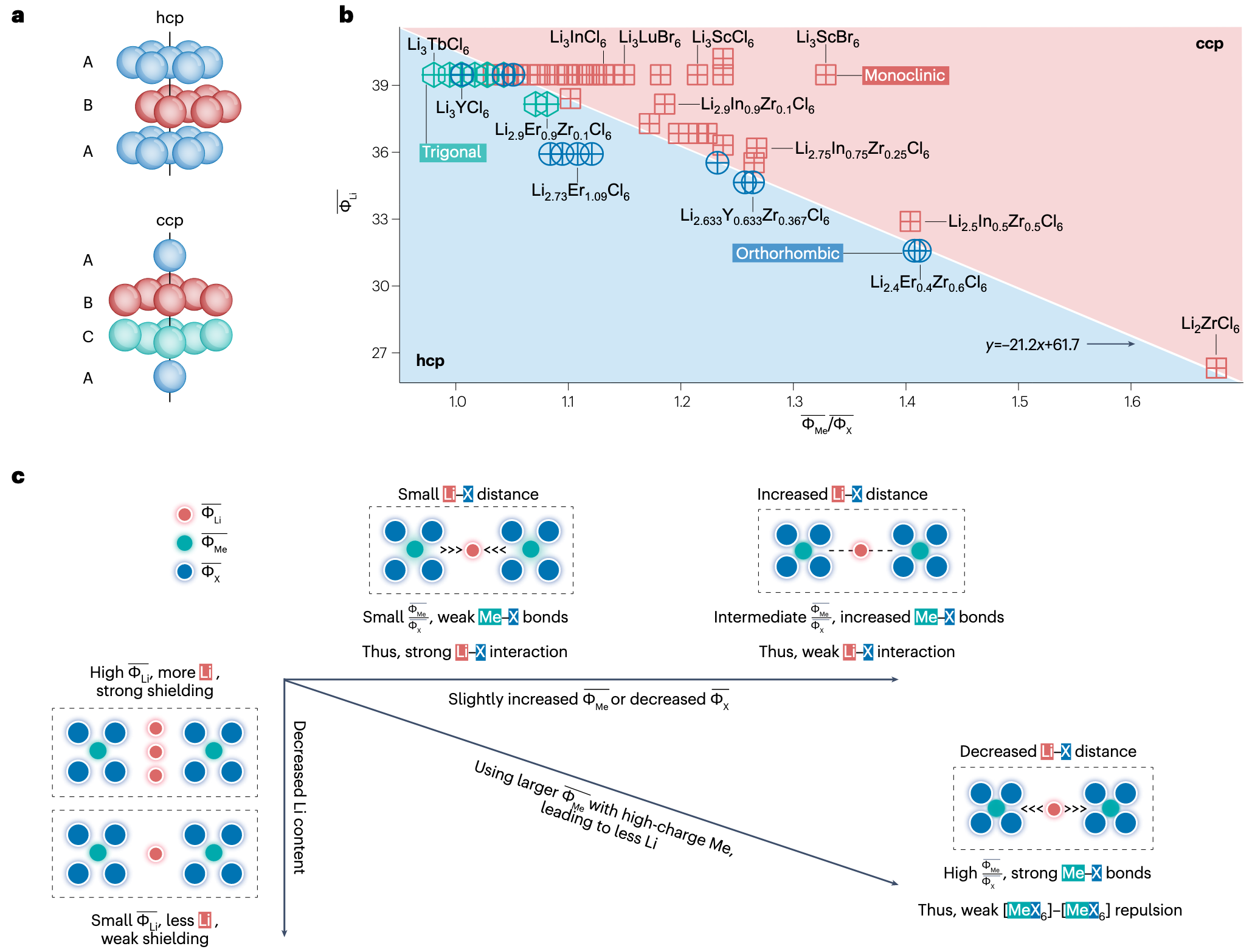
有趣的是,为什么这里的分界线恰好是一条直线呢?因为 是近似为常数的(只选用了 Cl- 和 Br- 两种阴离子,且主要以 Cl- 为主)。所以 实际上就是 乘了一个常数。然后 和 量纲一致,因此只能呈线性关系。
那这个比值有什么用呢?
嗯,于是进一步分析,得到了上面图 c 对电解质设计的指导。这里的图 c 坐标轴有点乱,其横轴表示增加 或者降低 , 纵轴代表降低 .
- 沿横轴看,增高 或降低 会使得 增大,增强 Me-X 相互作用,从而降低 Li-X 相互作用,让阴离子层之间具有更大的空隙,有利于锂离子通过。
- 如果 更高,则具有更高的离子屏蔽效应,同时会吸引阴离子,阻碍锂离子传输。
离子屏蔽效应 (ion shielding effect) 对离子电导率具有显著的影响。存在外部电场作用时,离子屏蔽会使得迁移离子收到的外部电场力变小,从而阻碍离子迁移。
目前存在多种方式来改善离子屏蔽效应。如通过掺杂的方式来改变晶体结构(晶体堆积方式)或者引入缺陷破坏离子屏蔽等。
# 发现新的电池材料
充放电过程中发生的结构相变,会严重影响电池的整体性能。
一般来说,氧化物包括三种重要的晶体结构类型:
- 尖晶石结构 (spinel, Fd-3m): 容易形成三维离子扩散通道,热稳定性优异,比容量低 —— 多用作电解质,如 LLZO 体系。
- 无序结构 (disordered, Fm-3m): 理论比容量大,具有较大的随机性,性质不稳定 —— 正在探索。
- 层状结构 (layered, R-3m): 高比容量,容易形成二维离子扩散通道,稳定性差 —— 多用作正极,如 LiCoO2.
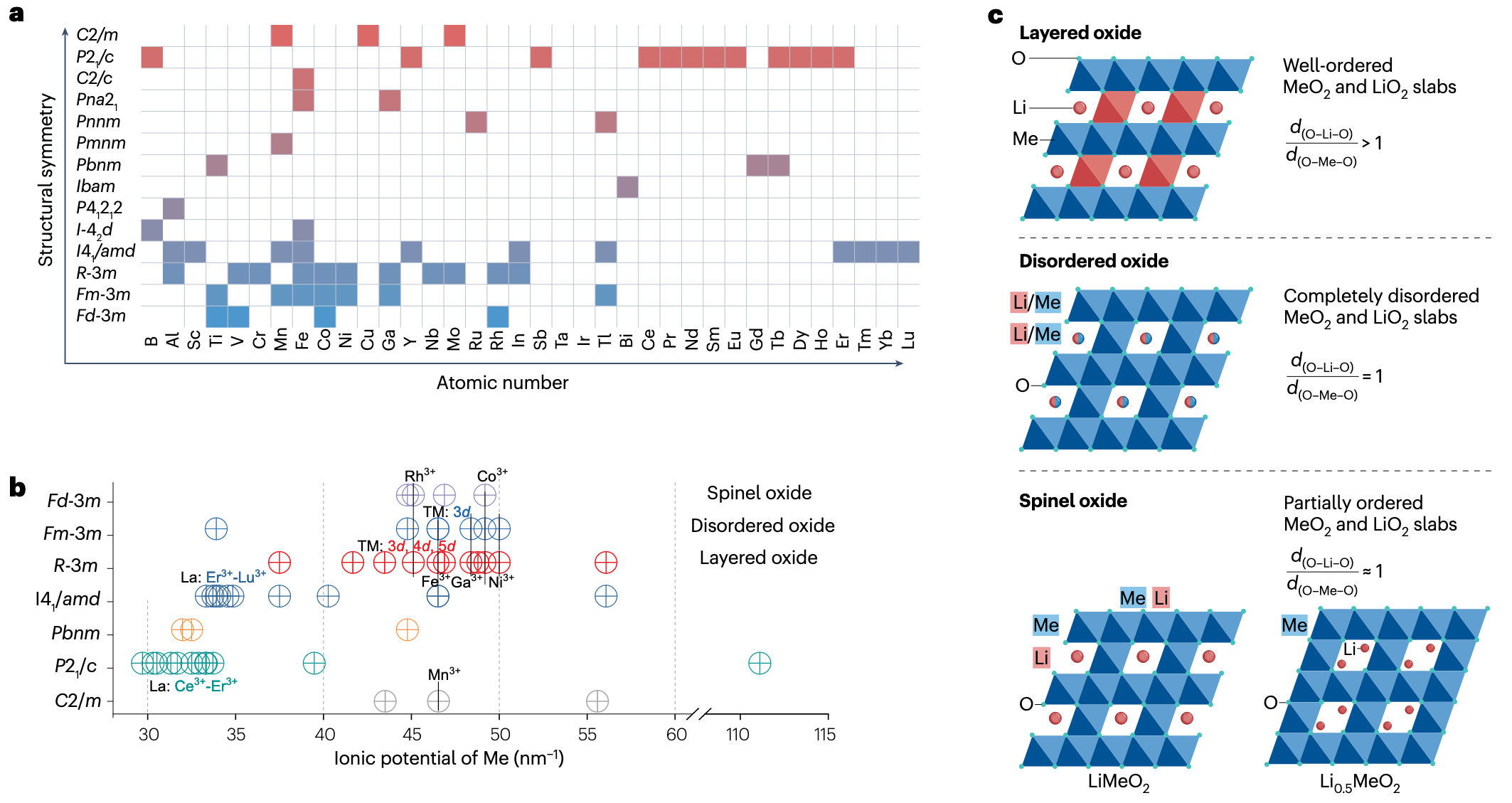
c 图展示了不同的键长所对应的晶体结构。
# 预测电池材料的电化学性质
# 相变性质
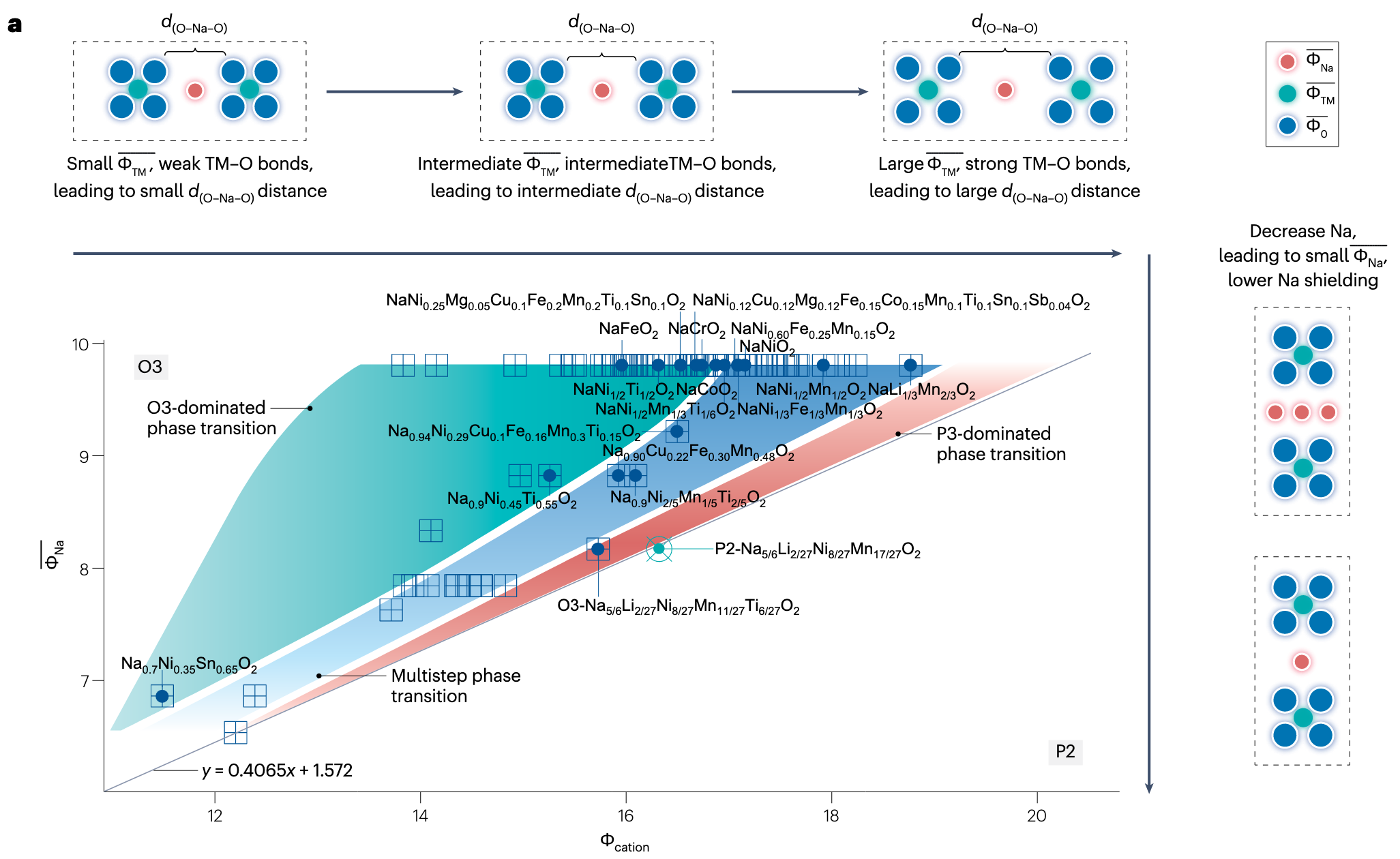
这里的 a 图其实和刚才的图差不多,都是描述离子势如何影响键长,从而影响晶体结构的。
# 氧化还原性质
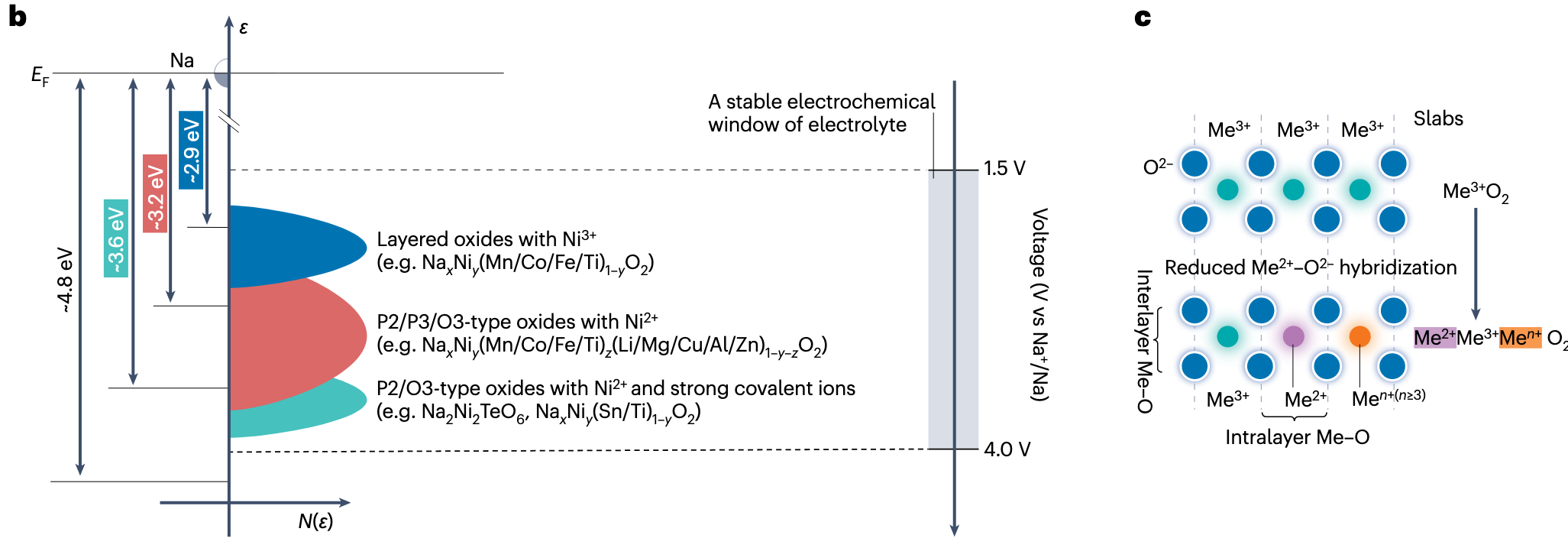
图 b 为钠离子层状正极的电极电位与 Ni 离子氧化还原对的关联。主要展示了几点影响因素:
- Ni 离子本身的价态:如 Ni2+ 比 Ni3+ 价态低,更容易被氧化。
- 共存离子的影响:共存离子的 越大,对 Ni 离子的电子的静电吸引越强,对应越高的氧化还原电位。
- 晶体结构的影响:结构差异改变离子配位数和键长,从而通过空间位阻效应影响电子状态。
图 c 是精细解释周围离子的离子势对氧化还原反映电位影响的图示。对应前面 “共存离子的影响”。具体来说:
- 周围离子的离子势越大,越容易吸引过渡金属的电子,从而更难发生氧化反应。
- 越大,TM-O 结合越紧密,更容易发生氧化还原反应。
- 层间距(晶体结构)也会影响氧化还原反应。